研究
- トップ
- 研究
研究紹介
移植免疫研究
濾胞性T細胞および記憶B細胞・形質細胞制御による抗体関連型拒絶反応の克服
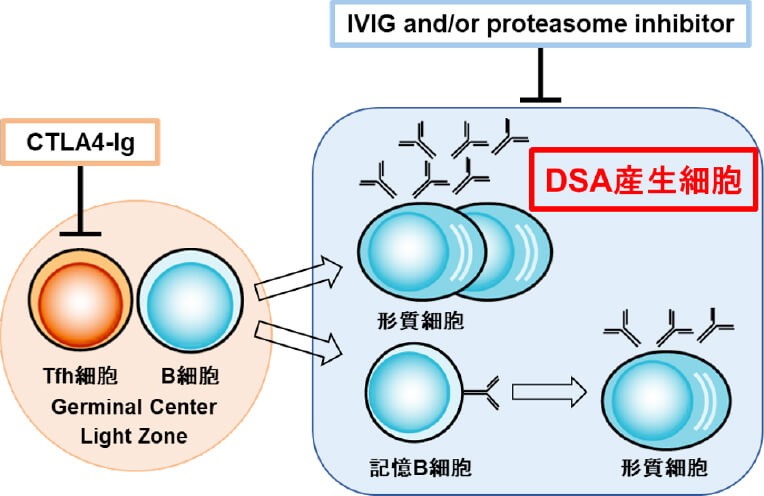
抗体関連型拒絶反応 (AMR)は移植臓器廃絶の主要な原因の1つであり、ドナー特異的抗HLA抗体 (DSA) の存在はAMRの危険性を高めます。我々は高度感作症例に対して、B細胞分化様式に即した術前脱感作療法を独自に考案し、DSA制御による移植を実践しています(Ide K, et al. Transplant Direct. 2015)。しかし移植後に新規に産生されたDSA (de novo DSA) によるAMRに対しては、免疫抑制療法が進歩した今日においても確立されておらず、新規治療法の開発が望まれています。我々は濾胞性ヘルパーT細胞 (Tfh)と記憶B細胞および形質細胞を制御することで、de novo DSA産生が抑制される可能性についての知見を得ました。今後、高感作マウスモデルで新規DSA産生制御法について検証し、実臨床への応用を目指しています。
ヒト化マウスを用いた慢性拒絶反応機序解明の試み
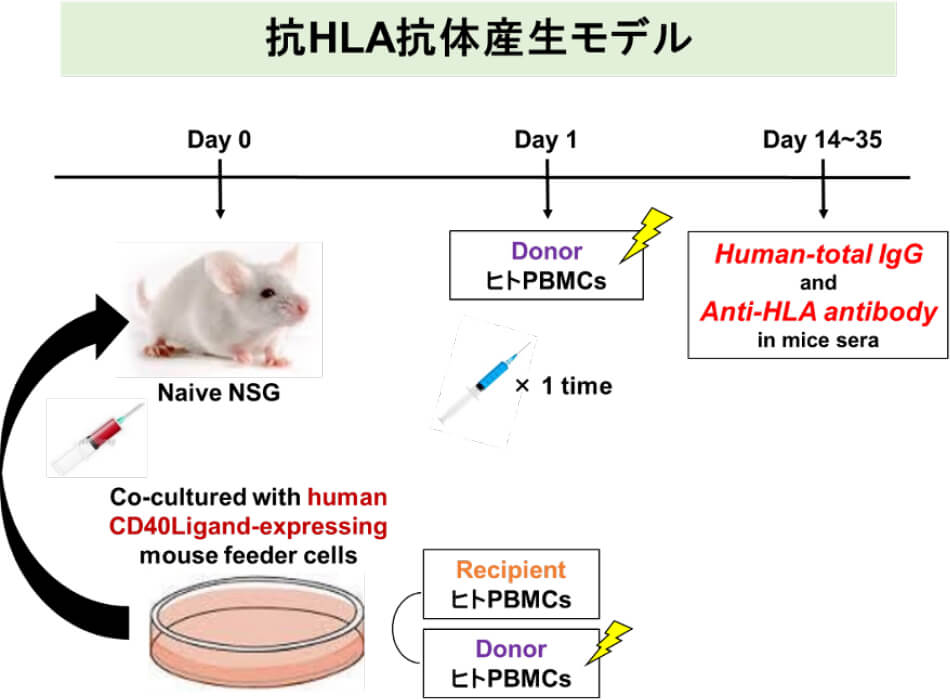
慢性拒絶反応のメカニズムとしてドナーのヒト白血球抗原(HLA)に対するHLA抗体による抗体関連型拒絶反応が原因として挙げられますが、明確な機序は現在も明らかにされていません。我々はヒト免疫細胞が構築されたヒト化マウスに着目し研究を進めてきました。従来のヒト化マウスではHLA抗体産生ヒト化マウスの作製はヒト末梢血を用いたモデルでは困難でしたが、B細胞活性化因子の一つであるヒトCD40Lを発現させたマウス胎児線維芽細胞上にレシピエント・ドナー末梢血単核球(PBMCs)を混合培養させてことによって、in vitro下に抗体産生促進させた状態の細胞を重度免疫不全マウスに投与し、さらに同一ドナーPBMCsで免疫することによって十分量のHLA抗体産生ヒト化マウスが作製され、一部のヒト化マウスではドナー特異的抗HLA抗体(DSA)のみ特異的に産生が抑制されていることが分かっています。このヒト化マウスモデルを用いてDSA産生に必要な因子の同定とそのメカニズムが解明されれば、慢性抗体性拒絶反応治療に応用できると考え、研究を行っています。
糖鎖抗原応答B細胞の特異的制御法の開発
臓器移植に関連する糖鎖抗原には血液型不適合移植で障壁となる血液型糖鎖抗原や、異種臓器移植で問題となる異種糖鎖抗原があります。血液型不適合移植は、現在安定した成績が得られるようになりましたが、異種移植の実現には糖鎖応答性B細胞の制御が不可欠です。異種糖鎖抗原応答性B細胞はカルシニューリン阻害剤で制御できませんが、当科研究室においてB細胞受容体 / TLR-MyD88の両経路を阻害することで、異種糖鎖抗原応答B細胞活性を克服し、抗体性拒絶引き起こす異種移植の実現に繋がる可能性を示しました(Sakai H, et al. Am J Transplant. 2021)。
異種ドナー臓器の細胞
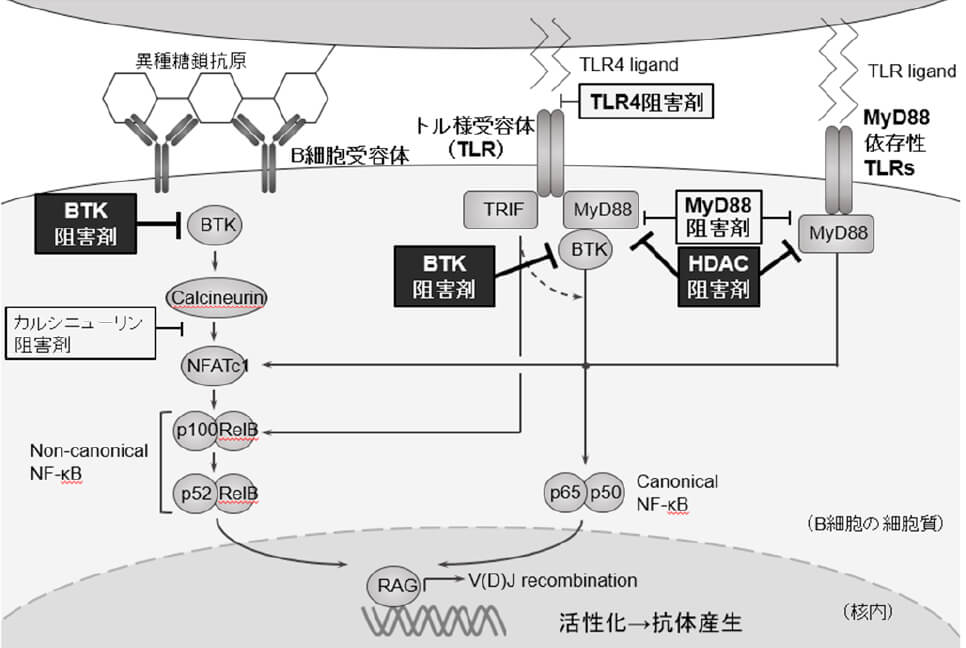
抗体性拒絶を惹起させるB細胞
アロ反応性T細胞に着目した自然免疫寛容機序の解明と新規寛容誘導法の開発
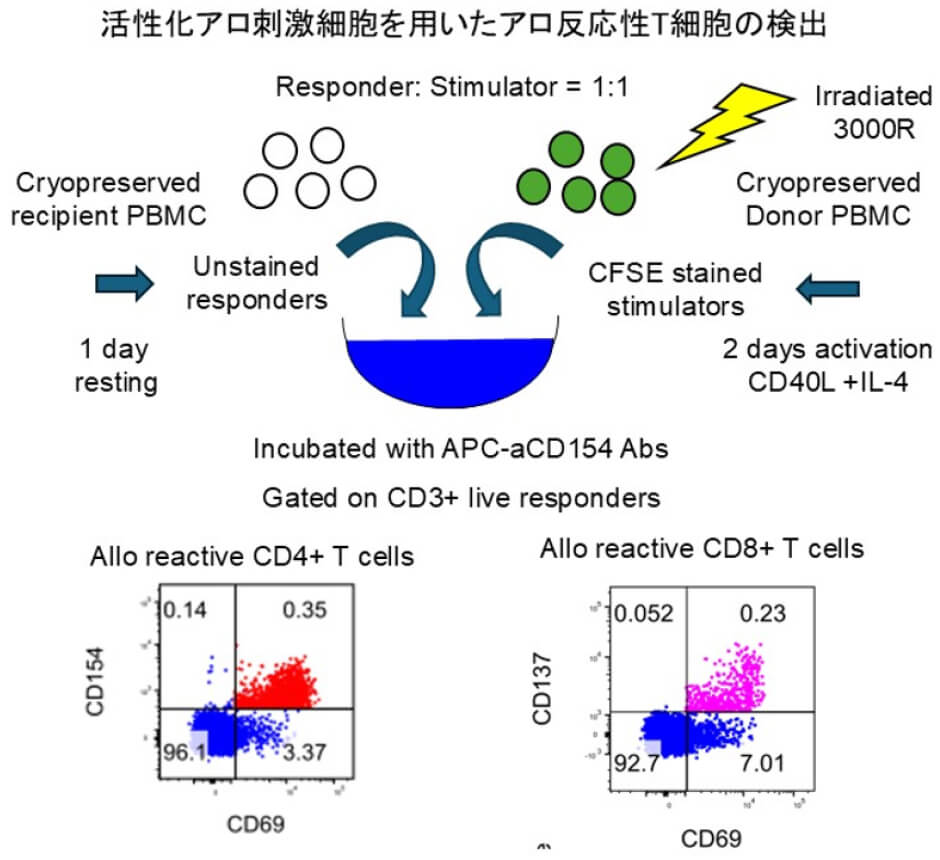
当科研究室では2005年以降、臓器移植後のCFSE-MLRによる免疫モニタリングを定期的に行い、免疫抑制療法の最適化を行っています。その経過において、抗ドナー応答は動的に変化すること、抗ドナー特異的な免疫低応答状態が頻繁に観察されることがわかりました。T細胞の抗原刺激特異的な反応を迅速に検出する活性化マーカーであるCD137, CD154を用いたアロ反応性T細胞検出アッセイを開発しました(Tanimine N, et.al. J Immunol Methods.2021,図改変)。臨床における免疫寛容状態のドナー特異的低応答機序ならびに自然免疫寛容機構について生体内で持続可能なT細胞制御機構を解析・解明し、新規免疫寛容誘導法の開発を行っています。
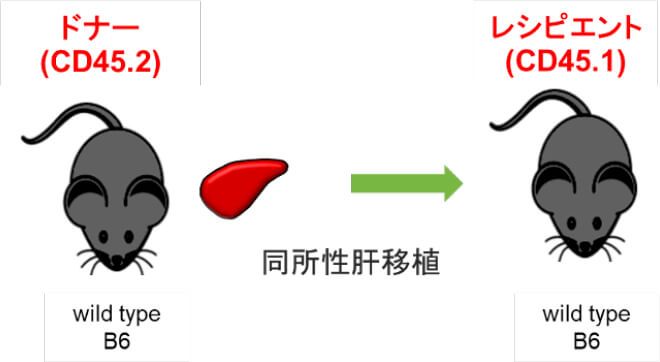
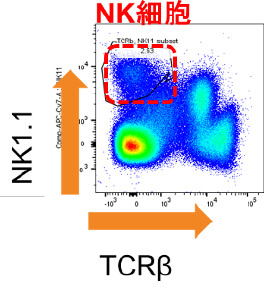
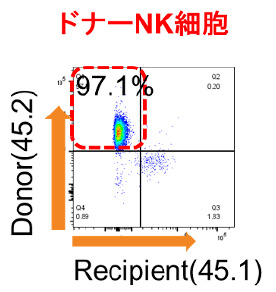
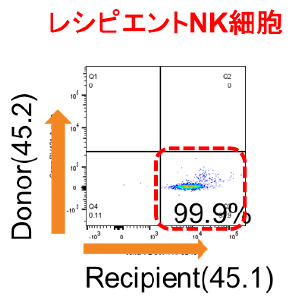
マウス同所性肝移植モデルを用いた肝移植後肝臓内NK細胞動態の解析
肝内免疫の特異性として、肝臓内NK細胞は肝内在性のNK細胞と、全身を循環している末梢型NK細胞に分けられ、肝内在性NK細胞 はTumor necrosis factor–related apoptosis-inducing ligand (TRAIL)を発現し、抗腫瘍効果を発揮することが知られています。我々は,これまでに生体肝移植において、ドナー肝臓由来活性化NK細胞を使用した肝移植後NK細胞療法により、肝移植後の肝細胞癌再発、血流感染を低下させることを報告してきました(Tashiro H, et al. Transplantation.2011, Ohira M, et al. Cancer Immunol Immunother.2022) 。しかし、肝移植後のグラフト肝臓内のNK細胞の動態については十分に解明されていません。我々の研究室では、マウス同所性肝移植の技術を確立しています (Nakano R, et al. Am J Transplant. 2021)。そこで、このモデルを用いて肝移植後肝臓内NK細胞動態の解析を行っています。これから得られる知見により、肝移植後NK細胞療法のさらなる機能的解析がすすむことが期待されます。
腫瘍免疫研究
患者由来の性質を再現する胃癌オルガノイドモデルを用いた個別化治療への応用
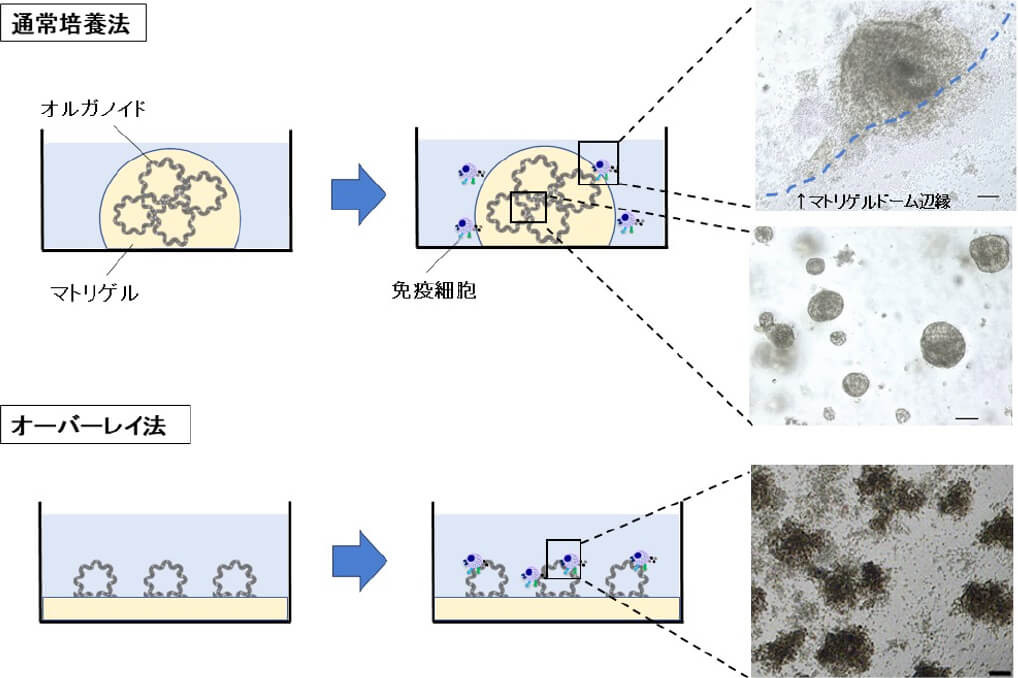
胃癌治療において、免疫チェックポイント阻害薬などの免疫治療が注目されています。免疫治療の効果は免疫状態やがんの性質によって大きく影響を受けるとされ、その開発や評価には、患者さん個別の腫瘍学的特徴を反映した胃癌細胞の培養と、免疫細胞との共培養法の確立が重要と考えます。より適切な細胞培養法として、オルガノイドに注目しました。オルガノイドは、組織から採取した幹細胞を三次元培養することで複数の細胞型と機能を再現し、従来の細胞株に比べ、個別の腫瘍学的特徴を強く反映しているとされます(図1)。当科で切除した胃癌症例から胃癌オルガノイドを樹立し、免疫細胞と共培養することで、試験管内でがん細胞-免疫細胞相互作用を再現することを目指したモデルの開発を行っています。当科研究室で開発した方法でいくつか技術的な問題点を克服し、オルガノイドと免疫細胞が十分接触・反応することを示しました(図2)。さらに免疫応答の程度を観察・定量化する方法について開発を進めています。このモデルは、免疫チェックポイント阻害薬の投与前効果予測や、新規免疫療法の開発に応用できるのではないかと期待しています。
図1
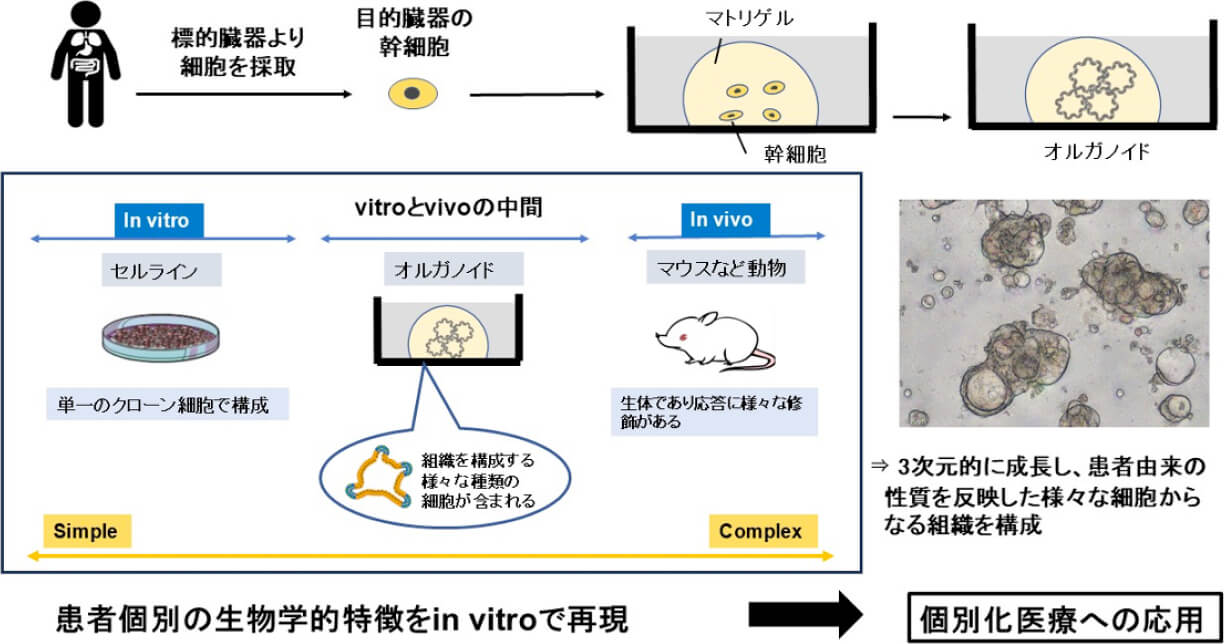
図2
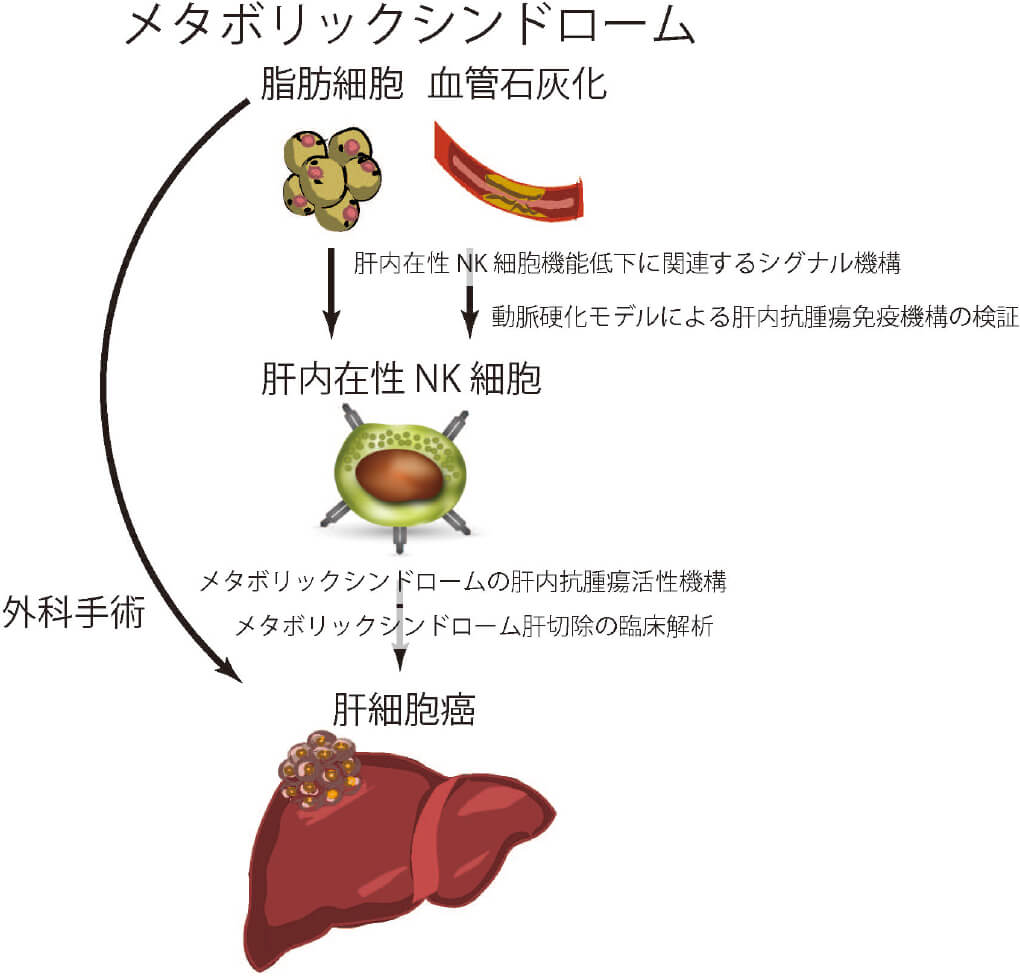
メタボリックシンドロームにおける肝内在性NK細胞機能低下の解明と統合的治療法の開発肝内在性NK細胞脆弱化モデルを用いた肝内在性NK細胞の分化および機能解析
メタボリックシンドロームがどのように肝内の「ナチュラルキラー細胞(NK細胞)」の働きに影響を与えるのか?メタボリックシンドロームは、心臓病や脳卒中のリスクを上げるだけでなく、手術後の合併症や癌の再発リスクも高まることが知られています。当科研究室では、肝内のNK細胞ががん細胞に対して強い働きを持ち、その働きが肝臓の手術後の免疫反応に重要であることを明らかにしてきました。特に、「TRAIL」という分子がその活動に重要で、その他にも、CXCL9やIL-33という因子が関与しています。大動脈の硬化(大動脈石灰化)は、肝臓のがん手術後の回復や再発のリスクと関わっていることが分かっており、当科研究室ではメタボリックシンドロームを持つマウスを使って、NK細胞の働きに影響を与える要因を詳しく研究しています。そして、実際の患者さんのサンプルを使って、これらの要因が手術後の結果や再発リスクとどのような関係にあるのかを探る予定です。最終的には、メタボリックシンドロームの患者さんの手術や治療の方法をよりよくするための新しいアプローチを開発することを目指しています。
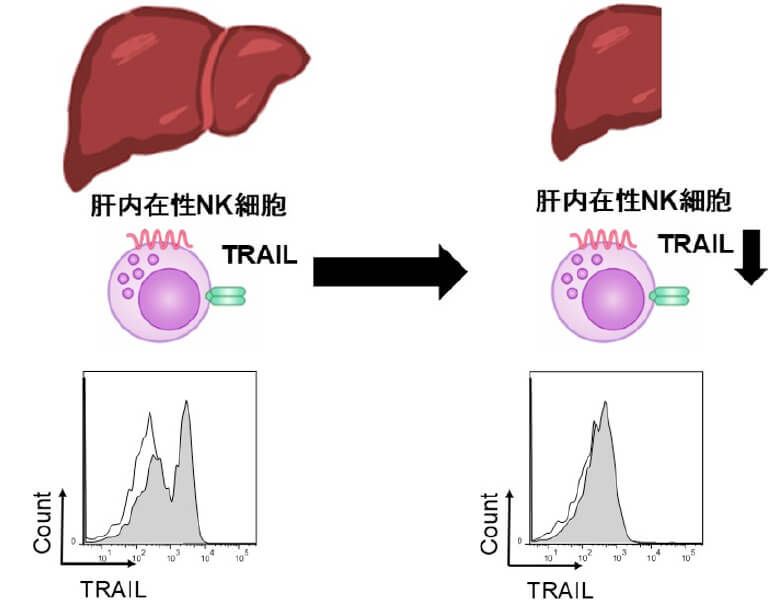
大腸癌肝転移の制御に関する肝内NK細胞の解析
大腸癌肝転移は大腸癌の遠隔転移で最も頻度が高く、大腸癌の主な死因の一つとなっています。肝転移の治療の難しさの一つに、肝転移切除後も高い確率で肝臓内に再発することがあります。肝臓内には、他の臓器や末梢血にはない特殊なナチュラルキラー(NK)細胞が存在します。この肝内在性NK細胞は、強力な抗腫瘍効果を持ち(Ishiyama K, et al. Hepatology.2006)、活性化マーカーであるTRAIL分子を強く発現しています。しかし、肝切除を行うとマウスの肝内在性NK細胞はTRAIL表出が無くなり抗腫瘍活性が低下することが分かりました(Ohira M, et al. Transplantation.2006)。つまり、肝切除を行うと肝臓内の免疫細胞であるNK細胞が腫瘍を攻撃する力が弱まっているのです。これまでに、肝内在性NK細胞に影響を与える因子として、肝転移の術前に化学療法を行うと肝内在性NK細胞が活性化されること (Hirata F, et al. Ann Gastroenterol Surg.2018)、栄養状態や動脈硬化が肝内在性NK細胞のTRAIL発現に影響していることを発見しました(Imaoka K, et al. Transplant Proc. 2023)。その他、肝内在性NK細胞の活性化にCXCL9(Yano T, et al. PLOS One.2017)、IL-33(Imaoka Y, et al. Hepatol Comun.2022)、mTORシグナル(Saparbay J. Transplant Int. 2019)が関与していることを報告しました。これらの研究結果は、肝内在性NK細胞を調整し、肝切除後に再発する大腸癌肝転移を制御する新規治療法の開発につながると考え研究を行っています。
肝切除後には肝内NK細胞活性が低下する
腫瘍の免疫制御機構におけるB細胞の役割
主要組織適合遺伝子複合体(MHC)classI/II 抗原を発現するB細胞は、抗体産生や抗原提示機構に加えて多彩な免疫制御機構が備わることが知られていますが、その病態意義については明らかでありません。当科研究室では、これまでにミエロイド系(CD11b+IgMhighB-1細胞)の表現型を示しProgrammed Death-Ligand (PD-L) 1/2を発現したB細胞、およびペプチド抗原に応答する抗炎症サイトカインIL-10/TGF-βを産生するB細胞(CD1d+CD5+Breg細胞)が臓器移植後のT細胞性免疫応答を抑制していることを解明しました。これは、拒絶反応を促進すると考えられていたB細胞の中に、アロ抗原特異的にT細胞を抑制し拒絶を回避させるユニークな表現系を示す抑制性B細胞のサブセットが存在することを意味します。そこで、移植免疫領域でのパラダイムシフトが、腫瘍免疫機構にも関連するか否かを、癌関連ペプチド抗原に対するT細胞応答の免疫回避機構に抑制性B細胞がどのような役割を果たしているかを解明中です。
プレシジョン医療研究
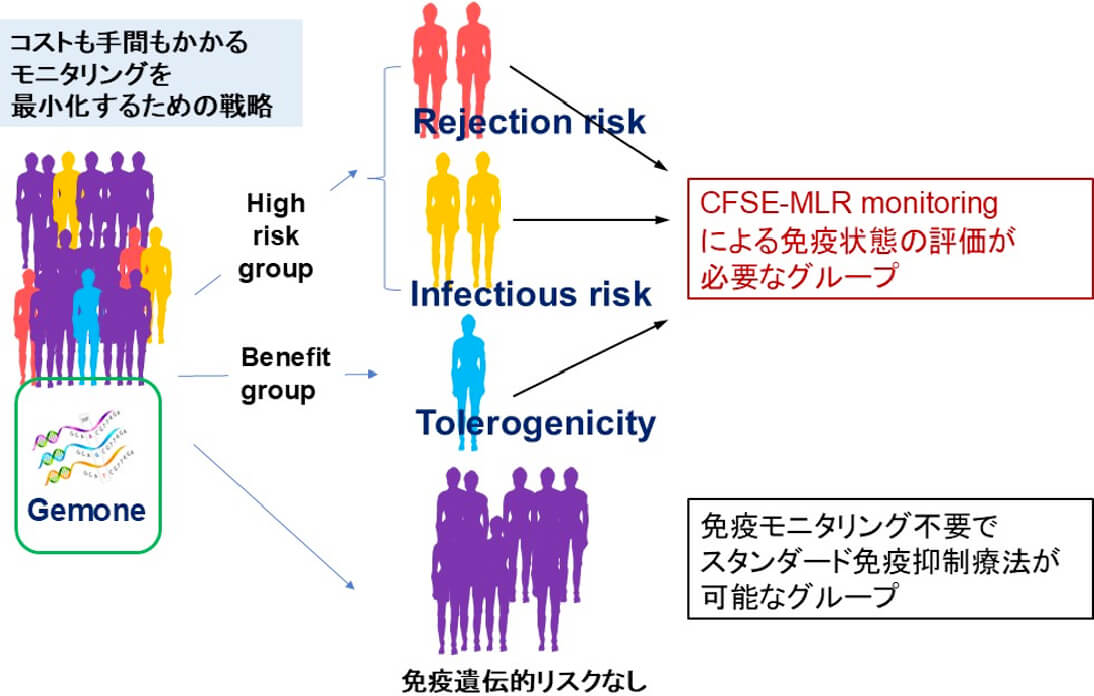
免疫担当細胞の一塩基多型(SNP)の臓器移植周術期への影響解析の研究
臓器移植後の画一的な免疫抑制療法では拒絶や感染症の発症リスクが懸念される免疫学的高リスク症例を免疫機能分子のゲノム情報を基盤として抽出し、免疫モニタリングによって重点的に個別化免疫抑制療法を適用することを目指した研究を実施しています。当科では、ゲノム情報として、臓器移植における免疫関連遺伝子のSNP(Single Nucleotide Polymorphism:一塩基多型)に注目しています。これまでに、拒絶反応やDSA産生、減感作への感受性や、術後感染症・BSI発症と原因菌の検索等に獲得免疫・自然免疫の複数のSNPsが関与する事を報告しております。その他の様々な免疫関連分子についても現在解析を進めており、バイオマーカーとしての有用性を検証中です。
- Fc-Gamma Receptor Polymorphisms Predispose Patients to Infectious Complications After Liver Transplantation. Shimizu S, et al. AJT. 2016.
- Fc-gamma receptor 3A polymorphism predicts the incidence of urinary tract infection in kidney-transplant recipients. Das LK, et al. Human Immunology. 2017.
- Significant association between FOXP3 gene polymorphism and steroid-resistant acute rejection in living donor liver transplantation. Sapana V, et al. Hepatology Communications. 2017.
- Effect of Fc-γ Receptor Polymorphism on Rituximab-Mediated B Cell Depletion in ABO-Incompatible Adult Living Donor Liver Transplantation. Sakai H, et al. Transplant Direct. 2017.
- Polymorphisms in CTLA-4 predict de novo donor specific antibody formation after kidney transplantation. Ono K, et al. Hum Immunol. 2022.
- Adoptive immunotherapy overcomes genetic susceptibility to bloodstream infections due to fc-gamma receptor polymorphisms after liver transplantation. Shimizu S, et al. AJT. 2022.
- Genetic Polymorphisms in Follicular Helper T Cell–Related Molecules Predispose Patients to De Novo Donor-Specific Antibody Formation After Kidney Transplantation. Ono K, et al. Transplant Proc. 2023.
免疫学的遺伝子多型データベースによる個別化医療
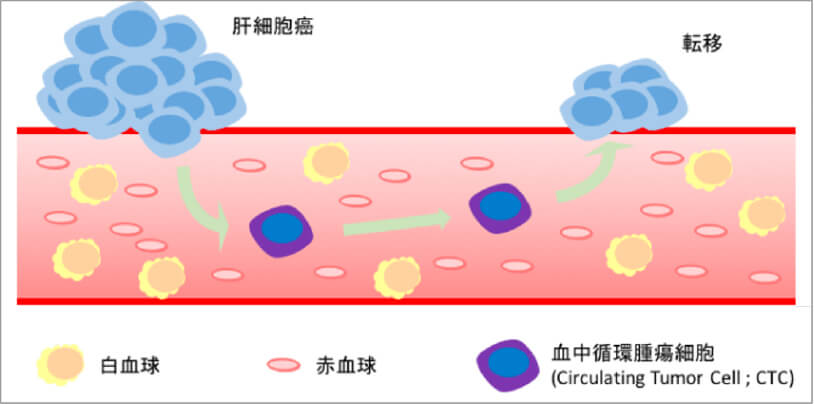
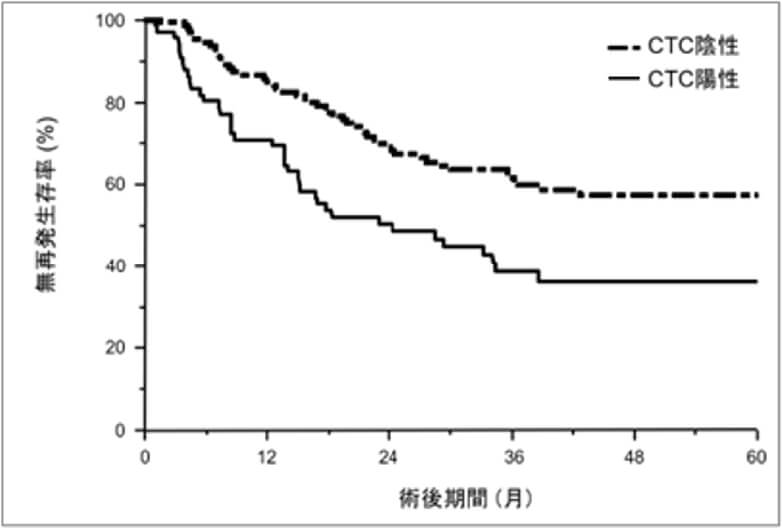
肝癌特異的な血中循環腫瘍細胞(CTC)検出法の開発とCTCを標的にした新規治療法の探索
癌が転移する機序としてCTCの関与があげられます。CTCは血中へ浸潤した癌細胞であり、転移能を有すると考えられていますが、血球細胞に比べて非常に少ないため、検出や解析が非常に困難です。我々は肝細胞癌に特異的な表面マーカーを使用し、肝細胞癌特異的なCTCを検出する方法を確立しました。CTC陽性は、病理学的門脈浸潤や術後再発の予測因子であることを明らかにしました(Hamaoka M, et al. PLoS One. 2019)。今後はCTCの遺伝子変異、表面抗原や免疫細胞に対する応答性を解析し、CTCを標的にした新たな治療法の開発を目指しています。
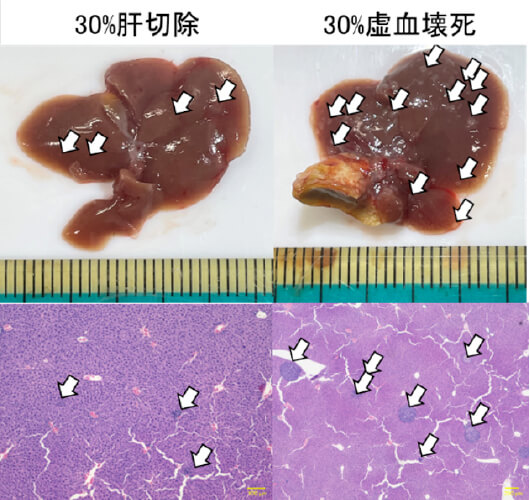
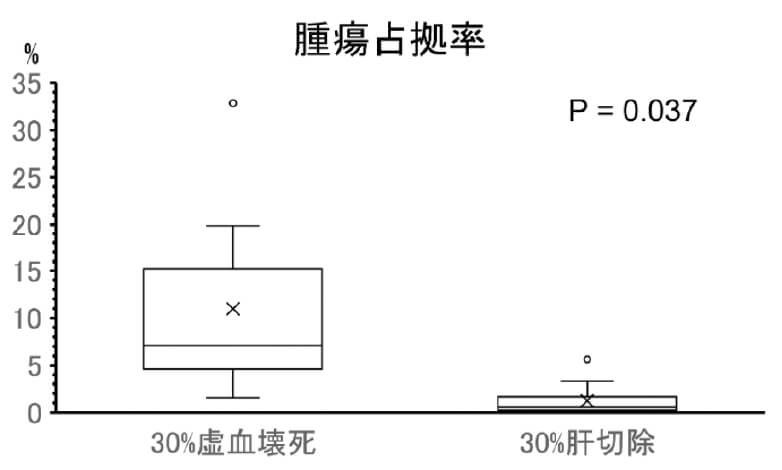
肝虚血壊死領域が肝癌促進に与える影響の解明と制御法の開発研究
肝手術では術後に虚血壊死領域を残さない「正しい肝切除」を心がけています。残存する虚血壊死領域が大きくなればなるほどに術後の予後に大きく影響することが示唆されています。残肝虚血壊死領域を有するマウスモデルを作成し、腫瘍生着とその原因の検討を行っています。30%肝切除モデルと30%虚血壊死モデルでの比較では、虚血壊死モデルにおいて腫瘍増生を確認しました。原因の探索とそれに対する治療薬の開発を目指しています。
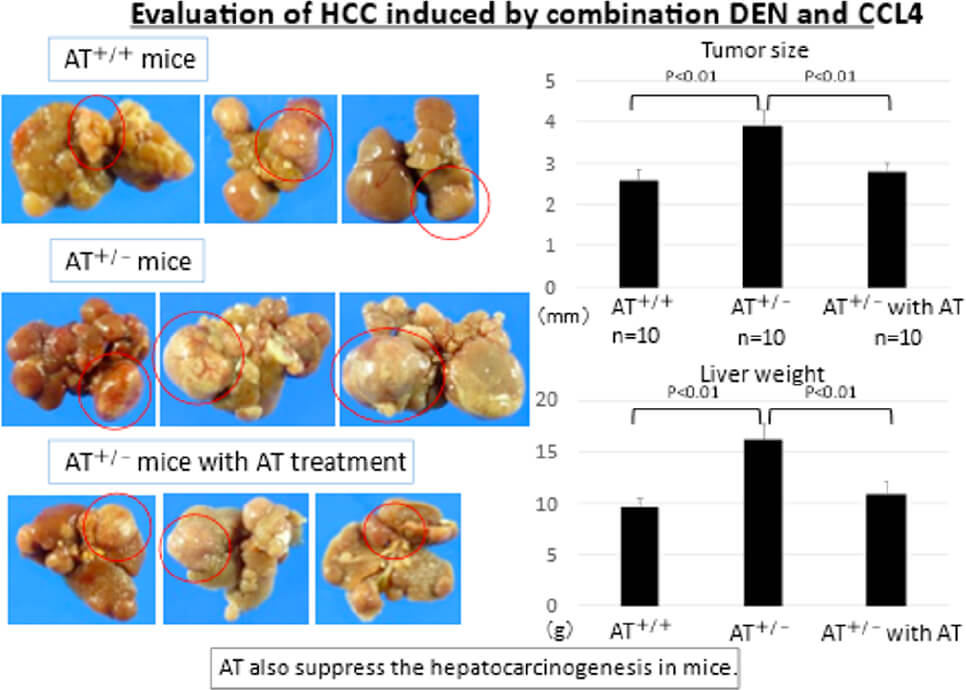
肝癌転移・浸潤機構に関する研究
臨床的に術前アンチトロンビン(AT)活性低値は肝細胞癌切除後の予後不良因子であり(Iwako H, et al. Ann Surg Oncol.2012)、ATは抗炎症作用を介して肝癌の進展を抑制すると考え基礎研究を行っています。ATノックアウトマウスを用い、ATの活性低値は肝癌を増大させ、AT製剤投与で抑制させることを証明しました。また、ATは好中球からのIL-8分泌を抑制し、抗炎症および抗腫瘍効果を有することを示しました(Iwako H, et al. J Surg Res.2019, Okimoto S, et al. Hepatol Res.2020)。
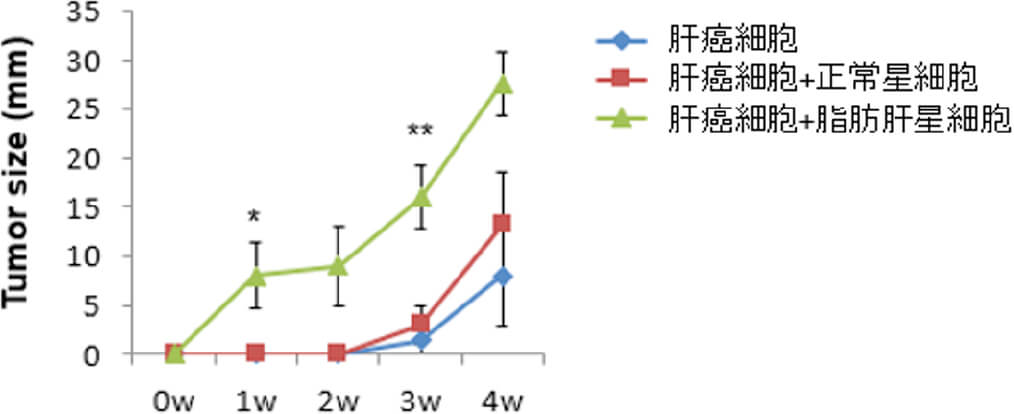
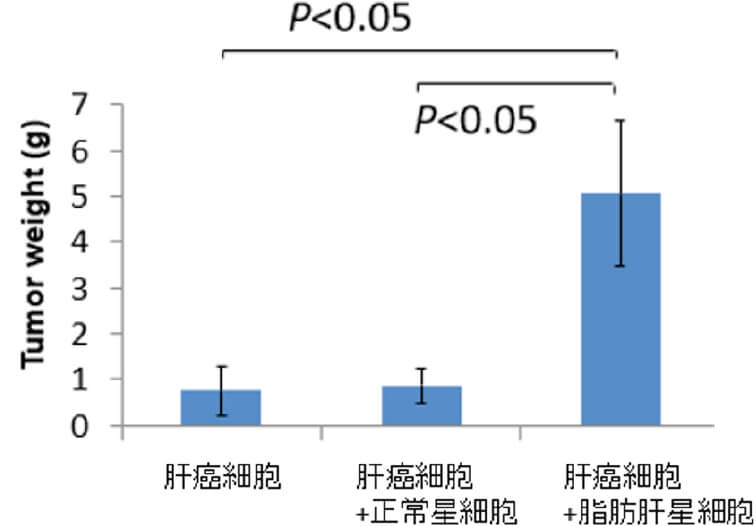
脂肪肝と腫瘍免疫微小環境
肝癌の発生母地である背景肝として、ウィルス性肝炎の治療が向上もあり、近年では「脂肪肝」が注目されています。日本に約2000万人いると言われる脂肪肝は、年々増加してきており、10人に1人に肝癌が発生しやすいと分かってきました。脂肪肝では脂肪蓄積によって炎症が引き起こされた結果、癌細胞を取り巻く免疫環境の変化が起こっていると考えられます。この変化が癌細胞に及ぼす影響を解明し、新たな治療法の開発を目指しています。動物モデルで正常肝と比較し脂肪肝では明らかに腫瘍増生が促進されていることが分かり、その原因究明に取り組んでいます。また、肝癌を取り巻く肝内微小環境としてはこれまでに「肝星細胞」に着目し、線維化や炎症を引き起こしていることなどを解明しています(Mikuriya Y, et al, Int J Cancer. 2015)。
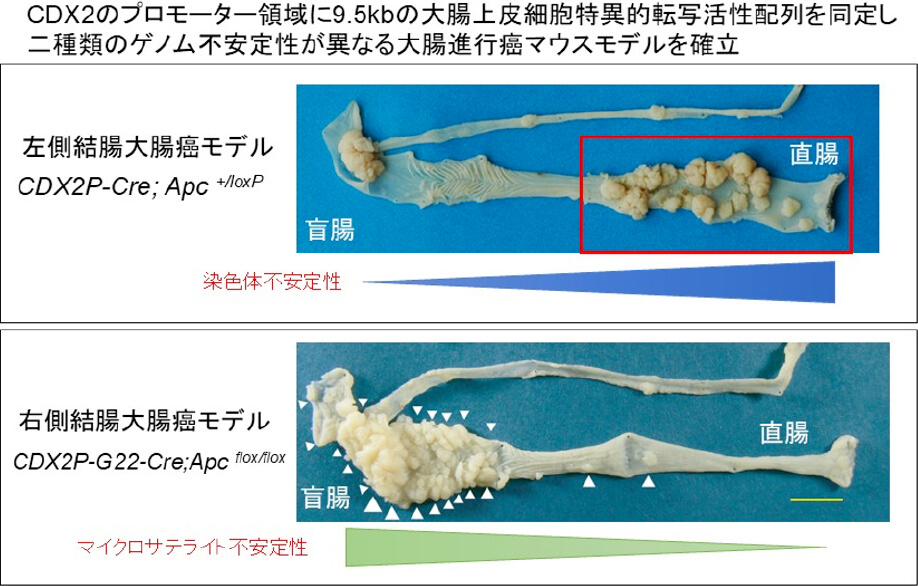
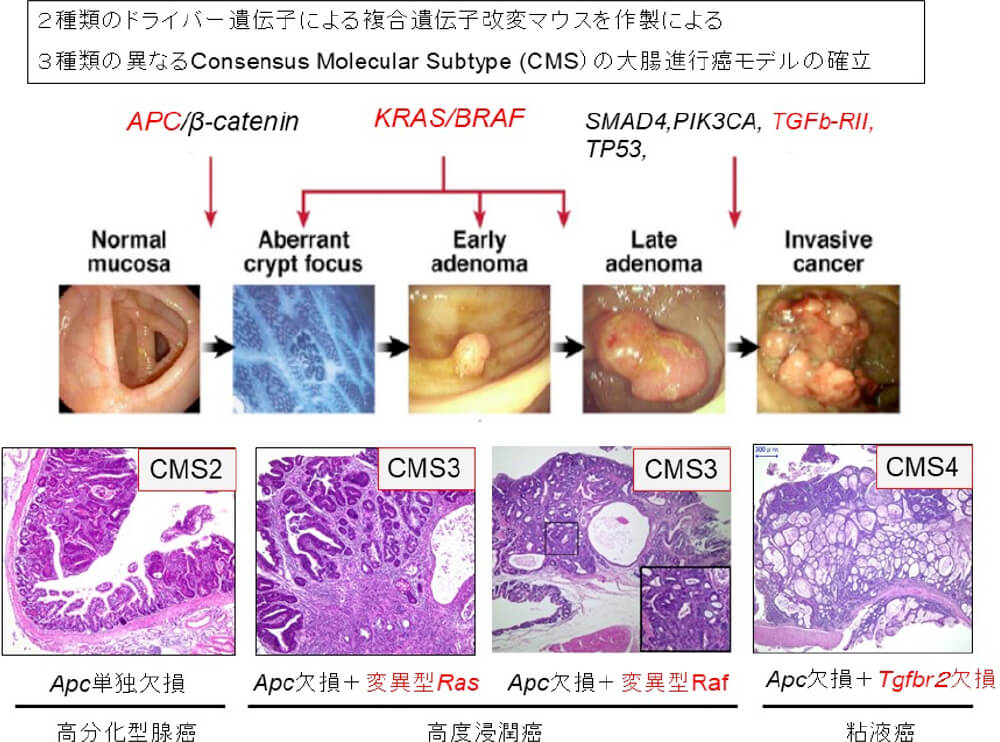
新規進行大腸癌マウスモデル作製による大腸癌の発癌浸潤機構の解明と臨床応用
大腸癌は複数のドライバー変異による多段階な発癌機序が知られています。我々は、腸上皮特異的ホメオボックス転写因子CDX2の大腸における発現抑制が低分化癌や未分化癌の原因となり、胃における異常発現が腸上皮化生を惹起することを報告しました。またCDX2のプロモーター領域に大腸上皮細胞特異的転写活性をもつ10.5kbのDNA配列を同定し、これを応用して2種類のゲノム不安定性の異なるコンディショナルApc欠損マウスを作成し、左側結腸癌モデルと右側結腸癌モデルを確立しました(Hinoi T, et al. Cancer Res. 2007, Akyol A, Hinoi T, et al. Nature Methods. 2008)。このモデルを応用して2種類の大腸癌ドライバー遺伝子を組み合わせることで、様々なConsensus Molecular Subtype(CMS)のマウス大腸進行癌モデルを確立するとともに、網羅的遺伝子発現解析により各ドライバー遺伝子の標的分子を同定しました。現在、浸潤型大腸癌マウスモデルを使ってドラッグリポジショニングによる治療薬の開発を行っています。またCMSの異なる腫瘍の全ゲノム解析を行いGenotype-Phenotypeの同定と新規大腸癌関連分子の同定を進めています。
大腸癌術後再発危険因子・治療効果予測因子の同定
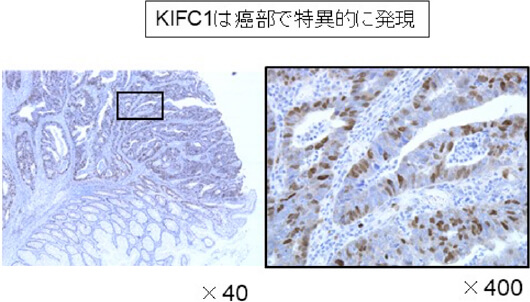
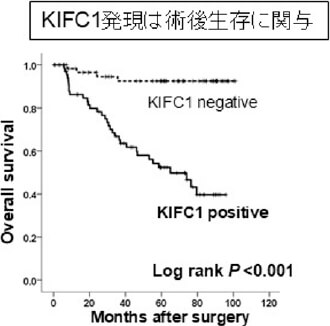
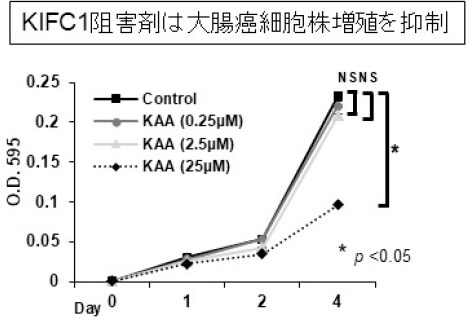
治癒切除が得られ、術後補助化学療法を受けた患者さんでも、時間経過とともに再発される方がおられ、そのリスク因子について解析を行っています。 pStageIII大腸癌において、癌発育先進部に存在する簇出(Tumor Budding)という腫瘍形態に着目し解析を行いました。237例(観察期間中央値:44.8カ月)のpStageIIIの患者さんで、高簇出症例は有意に再発率が高く(図1)、簇出は術後補助化学療法への抵抗性に関与する可能性を報告しました(Akabane S, et al. Int J Clin Oncol. 2021.)。また、中心体クラスタリングと関与するKinesin Family Member C1 (KIFC1)が、大腸癌細胞の癌幹細胞性・増殖に関与し、我々が開発した新規KIFC1阻害薬が細胞増殖を抑制する(図2)ことを世界に先駆け報告しています(Akabane S, et al. Pathol Int. 2021)。これらの成果から、KIFC1が癌幹細胞性を通じて簇出に関わり、化学療法への抵抗性を生み出す可能性を考えました。KIFC1が簇出ならびに耐性へ関与するメカニズムを明らかとし、KIFC1阻害剤によりその耐性を克服し得るか、検証を進めています。
図1. Stage III大腸癌におけるTumor Buddingの意義
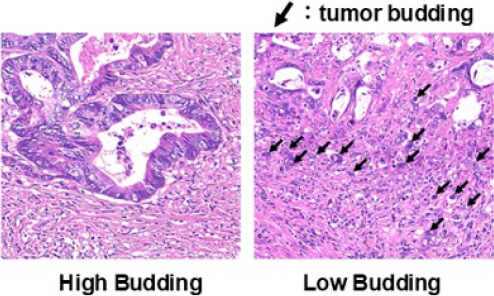
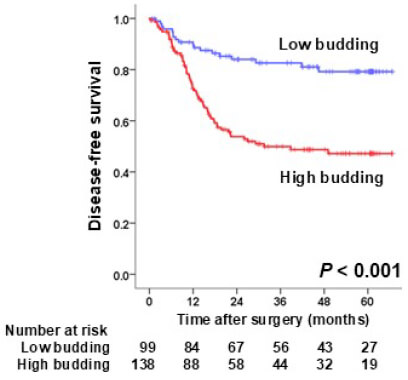
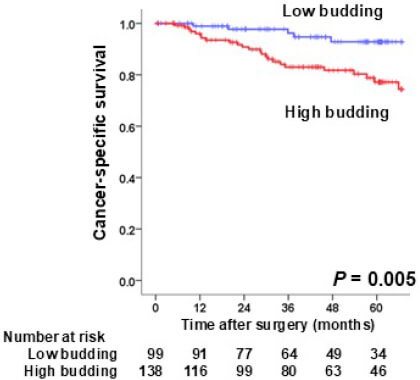
図2. 大腸癌とKIFC1の解析

消化器癌における遺伝性腫瘍症候群(リンチ症候群)の臨床診断・遺伝学的解析に関する研究
がんゲノム医療が保険診療となり、次世代シーケンサー(NGS)を使ったがんゲノム情報により、サブタイプ分類やターゲット遺伝子に対する治療法の開発が急速に進歩しています。一方で、Secondary findingsとして重要なPresumed Germline Pathogenic Variants(PGPVs)の解析ならびに血縁者診断の確立には、本邦における遺伝性腫瘍症候群の診断やデータベースの構築が重要となってきます。マイクロサテライト不安定性(MSI)検査は、リンチ症候群の第2次スクリーニング検査においても重要な意義を持っており、当科では2013年より同意の得られた大腸癌手術症例に対し、ユニバーサルスクリーニングとしてMSI検査を行ってきました。2013年4月から2023年3月までに当科でMSI検査が施行された870例中、MSI-H大腸癌は76例(9%)に認めました。そのうち改訂ベセスダガイドラインを満たした23症例がLynch症候群の候補となり、遺伝学的検査を行った13例のうち、6例(全体の0.6%)にミスマッチ修復遺伝子の生殖細胞系列病的バリアントを認めました。引き続き症例の集積を行うとともに、ミスマッチ修復遺伝子の病的バリアントが同定された患者さんの血縁者診断による未発症病的バリアント保持者の同定ならびにサーベイランスなどに活用する予定です。
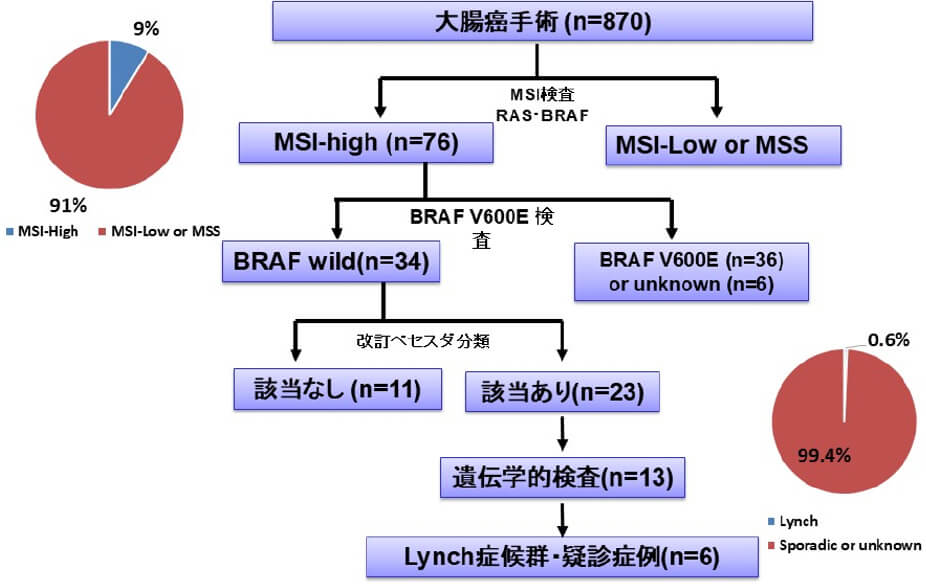
当科におけるMSIユニバーサルスクリーニングの結果
免疫代謝学研究
高度肥満症における免疫細胞を標的とした新しい治療法の創生
肥満症は全世界で増加の一途を辿っており、肥満症患者さんは糖尿病、脂質異常症、悪性腫瘍、動脈硬化性疾患、認知症などに高率に罹患し、肥満症をベースとした「メタボリックドミノ」と言われる病態の負の連鎖は死亡率の増加に直結します(Rubino F, et al. Nature. 2016)。肥満症に対する現在の内科的治療 (食事療法、運動療法、認知行動療法、薬物療法)では減量とその維持が極めて難しく、これに対して減量・代謝改善手術(減量手術)は高い安全性と有効性から世界中で広く行われていますが、少数ながら術後のリバウンドや治療効果が乏しい症例もあり、減量手術の治療の限界も明るみになってきました。さらに本邦では、2014年に腹腔鏡下スリーブ状胃切除術が保険収載されて以降、2020年、 2022年と保険適応が拡大されたものの、他国に比べると減量手術の保険適応基準は厳しいものであり、減量手術の恩恵を受けられない患者さんも少なくありません。そのため、肥満症に対する治療法において新たな展開が必要となっていると考えています。肥満状態では、脂肪の過剰蓄積による脂肪細胞の肥大化が起き、脂肪組織内に免疫細胞が浸潤します。その結果炎症性サイトカインが放出され、局所や全身の慢性炎症を引き起こし、糖尿病や脂質異常症といった代謝性疾患の原因となります(Cao H, J Endocrinol. 2014)。しかし、ヒトにおいては免疫細胞による慢性炎症が生じる機構については未だ不明な点が多いのが現状です。当科では移植免疫・腫瘍免疫において免疫細胞を中心とした研究成果を挙げてきました。その実績を生かして、減量手術を施行した患者さんの臨床サンプルを解析し、病態生理を明らかにすることを目指しています。現在の肥満症治療薬は食欲抑制を目標とした神経系がターゲットとなっていますが、慢性炎症の根源である免疫細胞の制御法が確立すれば、新たな肥満症治療法の創生に繋がると考えています。
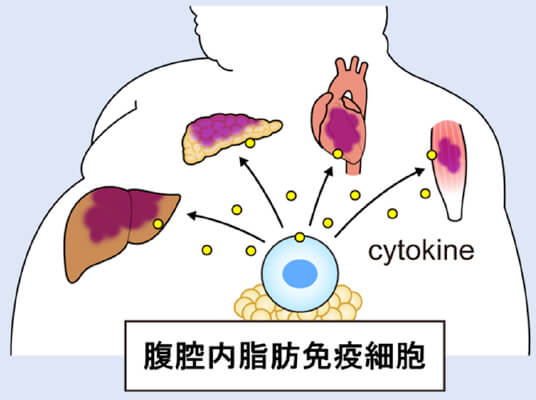
病的肥満症の腹腔内脂肪における免疫細胞の解析
当科では減量手術を施行した患者さんの末梢血液・腹腔内脂肪を用いて研究を行っています。現在までmicroarrayやflowcytometryを用いた解析を行い、肥満患者さんの末梢血液のサイトカイン産生に関わるCD56bright NK細胞の活性化の程度が減量手術前の減量効果に影響を与えることを報告しました(Chikuie E, et al. Medicine. 2023)。また、腹腔内脂肪免疫細胞と肥満の程度が深く関わっていることを明らかとし、学会で表彰されました。
これまでの受賞歴
- 2021年
第38回日本肥満症治療学会学術集会 JSTO優秀演題セッション理事長賞(最優秀賞) - 2022年
第29回西日本肥満研究会 若手臨床研究奨励賞受賞 - 2022年
第30回日本消化器関連学会週間 ポスター優秀演題賞受賞 - 2022年
第30回日本消化器関連学会週間 若手奨励賞受賞
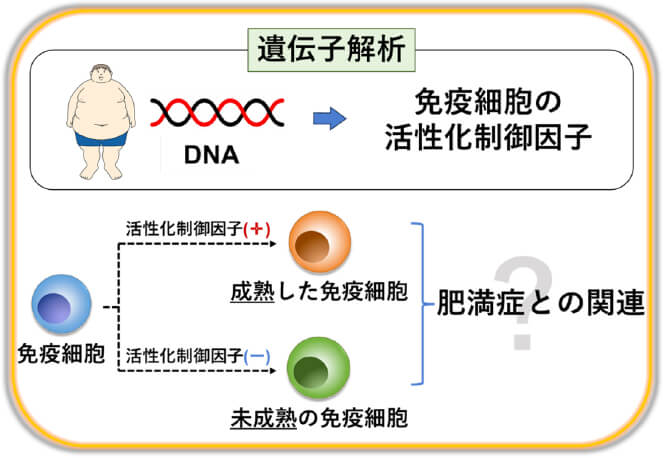
免疫細胞の成熟(活性化)は遺伝子レベルでも制御されていることが知られており、当研究室では肝細胞癌患者さんのNK細胞の成熟が肝細胞癌の再発に影響することを証明してきました(Tanimine N, et al. Cancer immunology research.2014)。肥満症患者さんのDNAを用いて免疫細胞の活性化制御因子を解析することで、肥満症の予測のみならず、肥満症治療への応用を目指しています。